
Il modello atomico proposto da Niels Bohr nel 1913 è la più famosa applicazione della quantizzazione dell'energia, che, insieme all'equazione di Schrödinger e alle spiegazioni teoriche sulla radiazione di corpo nero, sull'effetto fotoelettrico e sullo scattering Compton sono la base della meccanica quantistica.
Il modello, proposto per l'atomo di idrogeno, ottenne degli eccellenti risultati, coincidenti, entro il margine degli errori, con lo spettro sperimentale.
Gli studi di Bohr erano basati sul modello atomico di Rutherford, secondo il quale l'atomo è costituito da un nucleo compatto circondato da elettroni, molto più leggeri. A differenza del modello atomico di Rutherford, in quello di Bohr gli elettroni non sono posizionati in una qualsiasi orbita, ma secondo un criterio non arbitrario per cui possono scambiare con l'esterno solo determinate quantità di energia. Inoltre il modello di Bohr prevede che gli elettroni siano disposti intorno al nucleo su orbite stabili, corrispondenti a livelli energetici ben definiti, e che l'emissione o l'assorbimento di radiazione elettromagnetica si verifichi a seguito di transizioni elettroniche tra livelli quantici diversi. Inoltre, le proprietà chimiche dell'atomo sono determinate dal numero di elettroni che occupano il livello energetico più esterno.
Il modello di Bohr si basa su alcune ipotesi fondamentali:
Dopo aver introdotto queste ipotesi, Bohr studia la situazione dell'elettrone utilizzando le leggi della fisica classica. L'elettrone é soggetto alla forza di attrazione del nucleo. Questa forza provoca il suo moto di rotazione e quindi costituisce la forza centripeta. Gli elettroni nelle loro orbite possiedono una certa quantità di energia; essi infatti sono in moto, e quindi hanno energia cinetica; inoltre hanno energia potenziale dovuta all'attrazione elettrostatica tra elettrone e nucleo.
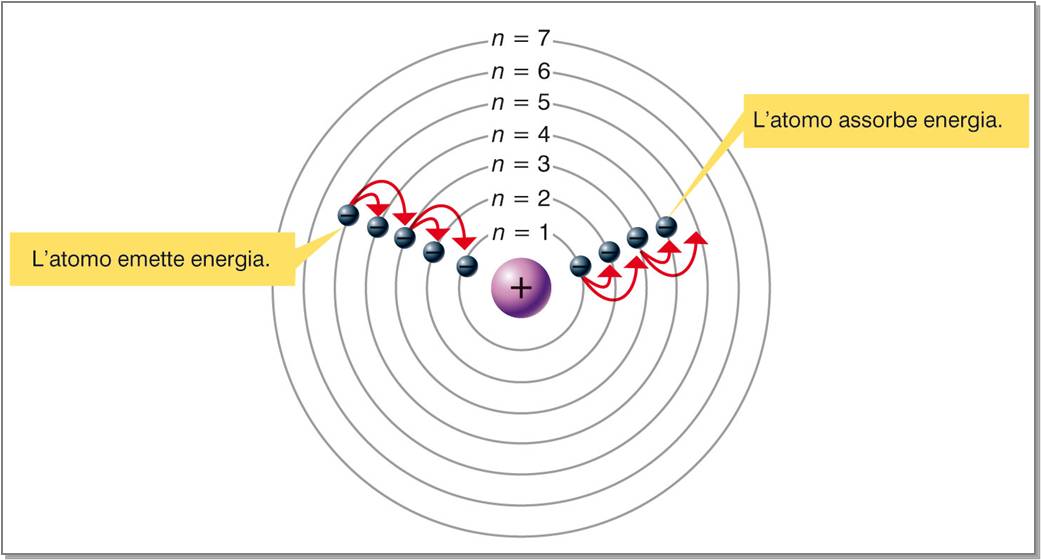
Per passare da un'orbita con energia minore a un'orbita con energia maggiore (cioè da un'orbita più interna a una più esterna), l'elettrone deve ricevere dall'esterno una quantità di energia corrispondente alla differenza di energia fra le due orbite; se invece passa da un'orbita con energia maggiore a un'orbita con energia minore, l'elettrone emette una quantità di energia pari alla differenza di energia fra le due orbite. L'energia viene emessa o assorbita sotto forma di radiazione elettromagnetica. Esiste una relazione matematica fra i valori di energia delle orbite di partenza e di arrivo e la frequenza della radiazioni:
E1 - E2 = h v
dove:
L'ipotesi di Bohr sulla struttura dell'atomo spiega quindi perché gli spettri di emissione degli atomi sono spettri discontinui, a righe: ogni riga corrisponde a un ben determinato valore di energia, che a sua volta corrisponde alla differenza di energia fra due orbite. Bohr pervenne al suo modello partendo dallo studio dello spettro del più semplice degli elementi, ovvero l'idrogeno.
Ogni orbita appartiene a un livello di energia. Il livello di energia più basso per l’idrogeno è il numero 1. Tale livello viene chiamato stato fondamentale. I livelli di energia superiore sono chiamati stati eccitati, perché l’elettrone li può raggiungere solo se riceve una sufficiente quantità di energia.
Vedi modello atomico di Dalton